医疗器械临床试验运行管理制度
医疗器械临床试验运行管理制度
一、目的
为使医疗器械临床试验运行有章可循,运行规范有序。
二、适用范围
本制度适用于临床试验机构办公室、各专业科室及医疗器械临床试验的全流程。
三、制度
(一)凡在我院开展医疗器械临床试验需经过临床试验机构审批,实施项目准入审查。未经机构审批通过的临床试验项目,不得在我院进行。
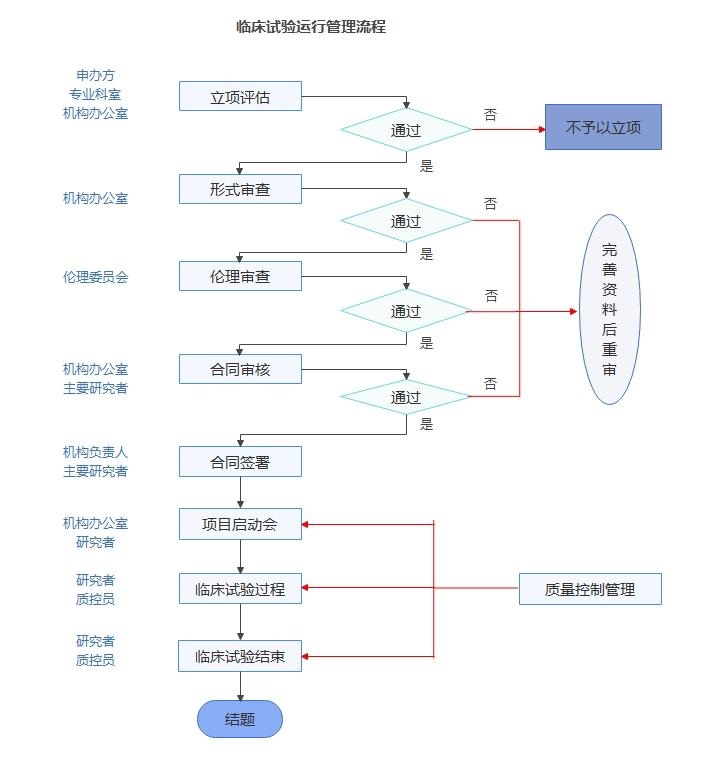
(二)临床试验项目运行按照附件《临床试验运行流程图》由申办方/研究者及相关部门按照相应的SOP进行。
(三)临床试验项目须完成如下流程后方可开始进行临床试验:项目经GCP机构审查批准、经伦理审查同意并取得批件、申办方与我院签订合同并按照合同支付相应款项。
(四)项目管理实行项目负责人(PI)负责制,PI对受试者安全、项目质量、进度负全责。
(五)试验过程中研究者应严格按照试验方案和各项标准操作规程进行,确保试验记录及时、真实、准确、完整、可靠,并确保临床试验中所有结论来源于原始数据。
(六)试验过程中,申办者/CRO、机构办公室、项目组之间需保持密切联系,协调处理试验中出现的问题,保证试验质量并配合各项稽查、检查和监查。
(七)试验过程中,试验方案、知情同意书等主要文件如需修改,必须再次通过机构和伦理委员会和中国人类遗传资源管理办公室(如适用)的审查和批准,未获批准前不得进行修改。
(八)试验过程中,若发生不良事件/严重不良事件,参照《不良事件及严重不良事件处理SOP》及《严重不良事件和可疑且非预期严重不良反应报告的SOP》及时处理和报告。
(九)试验完成后,分中心小结/总结报告由项目负责人提交至机构办审核。
(十)所有试验完成后,CRC/CRA及试验相关人员及时整理试验相关文件送往临床试验机构办公室归档。
四、附件
临床试验运行管理流程图
| 感动 | 同情 | 无聊 | 愤怒 | 搞笑 | 难过 | 高兴 | 路过 |










 公安备案号:44030502003112
公安备案号:44030502003112